proceso, conocido como oxidación, lo podemos observar en las tuberías, en la herrería y es relevante en las industrias de la construcción y marítima, ya que ésta última tiene un gasto de millones de pesos al año para combatirla. La oxidación también tiene que ver con la combustión que usas a diario al calentar alimentos en la estufa ó el agua para bañarte, así como la que ocurre en el motor de los automóviles y, en la síntesis de algunos medicamentos.
DESARROLLO
REACCIONES DE OXIGENO
El oxígeno es el elemento más abundante en el planeta Tierra, constituye aproximadamente el 50% en masa de la corteza terrestre y forma el 21% en volumen de la atmósfera; es componente activo del aire, se encuentra presente en el agua y como óxidos con otros elementos. Reacciona tanto con metales como con no metales y, entre los no metales es el segundo en reactividad química, después del flúor.
Existen dos alótropos del oxígeno, el más común es la molécula diatómica O2, el otro es el ozono que es una molécula triatómica, O3.
Un ejemplo de las reacciones del oxígeno con un metal, es la que ocurre con el magnesio al someterlo a la reacción de oxidación en una flama, pues desprende una intensa luz blanca y se convierte en un sólido blanco muy frágil; el producto de esta reacción es un óxido metálico llamado óxido de magnesio.
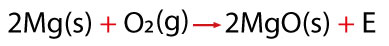
Reacciones de óxido con agua
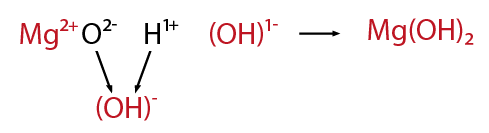
Después de la formación de los óxidos correspondientes tanto metálicos como no metálicos, es factible combinarlos con agua para formar nuevos compuestos. En el caso de los óxidos metálicos cuando interactúan con agua formanhidróxidos. Retomando el ejemplo del magnesio, se observa lo siguiente.
El óxido de magnesio en presencia de agua forma el hidróxido de magnesio.
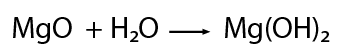
Los óxidos no metálicos en presencia de agua forman ácidos del tipo oxiácido.
Por ejemplo en el dióxido de carbono o anhídrido carbónico al reaccionar con agua, produce una molécula de ácido carbónico.

Observa que sólo se suman la cantidad de elementos que intervienen en la síntesis de los ácidos, empezando por la calidad ácido representado por los hidrógenos, después el no metal y finalmente la cantidad de oxígenos que intervienen en la esquematización simbólica de la reacción para formar ácidos.
NReglas de nomenclatura
La nomenclatura química es un conjunto de reglas que se aplican para nombrar y representar con símbolos y fórmulas a los elementos y compuestos químicos. Actualmente se aceptan tres sistemas de nomenclatura donde se agrupan y nombran a los compuestos inorgánicos:
- Sistema de nomenclatura estequimétrico ó sistemático de la Unión Internacional de Química Pura y Aplicada, (IUPAC).
- Sistema de nomenclatura funcional, clásico ó tradicional.
- Sistema de nomenclatura Stock.
A continuación se revisarán cada uno de estos tipos de nomenclatura para que aprendas a nombrar y formar los siguientes compuestos: óxidos metálicos, óxidos ácidos, hidróxidos, ácidos e hidrácidos.
Nomenclatura Stock
Se nombra con la palabra genérica óxido seguido de la preposición de enseguida el nombre del metal con el que se combinó, por ejemplo: óxido de calcio.
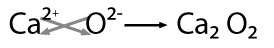
En este ejemplo hay posibilidad de obtener el mínimo común divisor entre los valores por lo que se obtiene: CaO -óxido de calcio-.
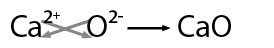
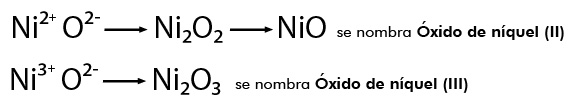
Cuando el metal presenta más de una valencia se nombran con la palabra genérica óxido seguida de la preposición de y después el nombre del metal, escribiendo entre paréntesis con número romano el valor de la valencia, por ejemplo:
Nomenclatura clásica ó tradicional
Estos mismos compuestos se pueden nombrar con la palabra genérica óxido seguida del nombre del metal con el sufijo oso para el valor menor de la valencia y con el sufijo ico cuando el valor de su valencia es mayor, por ejemplo:

Nomenclatura IUPAC
La IUPAC determina que estos compuestos se nombran a partir de la cantidad de elementos que los constituyen, por ejemplo:
NiO se nombra Monóxido de níquel y el Ni2O3 Trióxido de diníquel
Balanceo
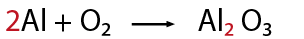
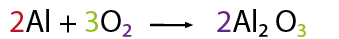
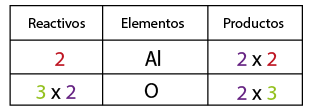
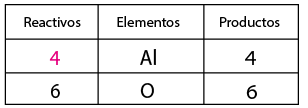
El balanceo consiste en igualar el número de átomos de cada elemento tanto en los reactivos como en los productos, y sirve para verificar la Ley de la Conservación de la Materia (La materia no se crea ni se destruye solo se transforma).

1-Contar el número de elementos existentes en dicha ecuación de lado de los reactivos y del lado de los productos, empezando por: metales, no metales, dejando para el final al oxígeno e hidrógeno (en caso de que la ecuación los contenga).
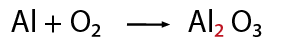

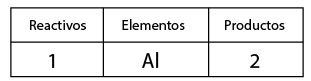


2 hidroxidos y acidos
3 nomenclatura
4 balanceo
LABORATORIO VIRTUAL
ACTIVIDAD FINAL (AHORCADO Y MEMORAMA)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
No hay comentarios:
Publicar un comentario